INDICE
1. Qué es el Átomo?
2.Modelos Atomicos.
2.1 John Dalton.
2.2 Joseph John Thomson.
2.3 Ernest Rutherford.
2.4 Neils Bohr.
2.5 Arnold Sommerfeld
2.6 Erwin Shrondinger.
1. ÁTOMO.
La filosofía atomista de Leucipo y Demócrito podía resumirse en:
žLos átomos son eternos, indivisibles, homogéneos e invisibles.
žLos átomos se diferencian en su forma y tamaño.
žLas propiedades de la materia varían según el agrupamiento de los átomos.
 |
| Democrito |
 |
| Leucipo |
2. MODELOS ATOMICOS.
2.1 JOHN DALTON
 | ||
| Jhon Dalton. |
ž Los elementos químicos están formados por partículas muy pequeñas e indivisibles llamadas átomos.
ž Todos los átomos de un elemento químico dado son idénticos en su masa y demás propiedades.
žLos átomos de diferentes elementos químicos son distintos, en particular sus masas son diferentes.
žLos átomos son indestructibles y retienen su identidad en los cambios químicos
žLos compuestos se forman cuando átomos de diferentes elementos se combinan entre sí, en una relación de números enteros y sencilla, formando entidades definidas (hoy llamadas moléculas).
Para Dalton el atamo era una particula solida parecida a una pelota de golf.
2.2 JOSEPH JOHN THOMSON.
 | |
| J.J. Thomson. |
A Thomson se le adjudica el descibrimiento de la carga negativa que tiene el átomo (electrón)
žFisico Britanico (1856-1940)
žAtravez de un experimento con rayos catodicos que pasaba por un campo magnetico y otro electrico descubrio que átomo tenia particulas con cargas negativas (electrones)
žPropuso entonces un modelo para el átomo en el que la mayoría de la masa aparecía asociada con la carga positiva (dada la poca masa del electrón en comparación con la de los átomos) y suponiendo que había un cierto número de electrones distribuidos uniformemente dentro de esa masa de carga positiva (como un budin con pasas en la que los electrones estuviesen incrustados.
2.3 ERNEST RUTHERFORD.
 | |
| E. Rutherford. |
Cientifico Neozelandes que represento un avance sobre el modelo de Thomson, ya que mantiene que el átomo se compone de una parte positiva y una negativa, sin embargo, postula que la parte positiva se concentra en un núcleo, el cual también contiene virtualmente toda la masa del átomo, mientras que los electrones se ubican en una corteza orbitando al núcleo en órbitas circulares con un espacio vacío entre ellos.
 | ||
| Modelo de Rutherford |
2.4 NEILS BOHR.
 |
| N. Bohr. |
žCientifico Danes que en 1911propuso un modelo atomico parecido al de Rutherford solo que en este caso el número de orbitas para el electrón estaba restringida por su nivel de energía y solo podia pasar de orbita si absorbia una cantidad de energia específica(quanto)
 |
| Modelo Bohr |
2.5 ARNOLD SOMMERFELD.
 |
| A. Sommerfeld |
žFisico aleman que en 1916 cuando Sommerfeld perfeccionó el modelo atómico de Bohr,. De este modo, hizo dos básicas modificaciones:
- Los electrones describían órbitas cuasi- elípticas.
- Velocidades relativistas (casi la velocidad de la luz).
žSommerfeld defendió, que el núcleo de los átomos no es permanece quieto, sino que ya sea electrón o núcleo, ambos realizan un movimiento entorno al centro de masas del sistema,
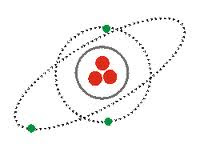 |
| Modelo Sommerfeld |
2.6 ERWIN SHRONDINGER
 | ||
| E. Shrondinger |
Este fisico austriacods En 1926 En el modelo de Schrödinger se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo. En vez de esto, Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa la probabilidad de presencia en una región delimitada del espacio.
 |
| Modelo Shrondinger |
CONTESTA LAS SIGUIENTES LAGUNAS.


